Résumé
Dans cet article, nous allons nous intéresser au diagramme d’état du corps pur : diagramme (P, T).
Nous commencerons par rappeler les différents états physiques du corps pur ainsi que les principaux changements d’état possibles.
Ensuite, nous décrirons le diagramme (P, T) d’un corps pur (cas général) et les principales notions à connaître.
Les différents états physiques du corps pur
Un corps pur (substance composée d’une seule espèce chimique) peut exister sous différents états physiques dont les plus courants sont : l’état solide, l’état liquide et l’état gazeux.
Les changements d’état du corps pur
Sous l’effet de la température et/ou de la pression, un corps pur peut passer d’un état physique à un autre (transformation physique) : on dit qu’il y a changement d’état du corps pur.
Les principaux changements d’état (aussi appelés transitions de phases) d’un corps pur et leurs noms respectifs sont représentés sur le schéma ci-dessous :
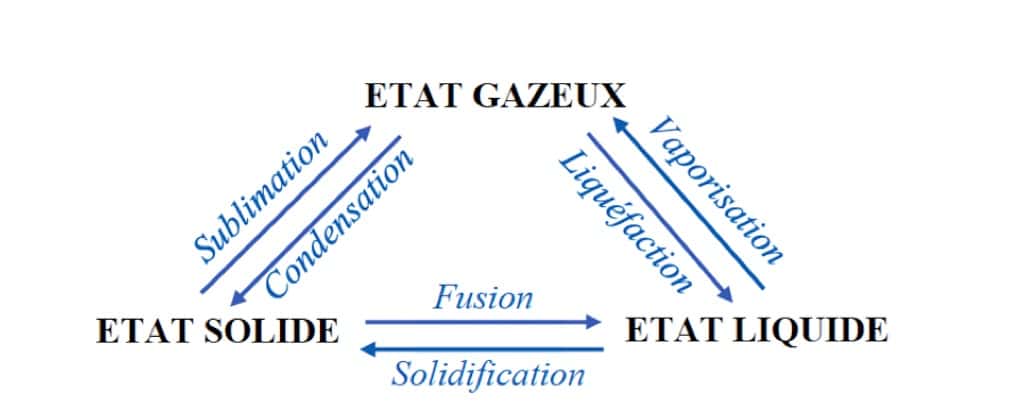
Changements d’état d’un corps pur et leurs noms respectifs
Le diagramme d’état du corps pur : diagramme (P, T)
Le diagramme d’état du corps pur usuel (aussi appelé diagramme de phases du corps pur) est une représentation graphique qui indique les domaines de stabilité des phases du corps pur (i.e. solide, liquide et gazeuse) en fonction des conditions de température (T) et de pression (P).
Pour rappel, une phase est généralement définie comme « une région de l’espace où les grandeurs intensives sont des fonctions continues des coordonnées de l’espace ».
Les diagrammes (P, T) des corps purs usuels ont généralement une « allure » similaire. Il est donc important de connaître cette « allure » et de savoir interpréter ces diagrammes.
L’allure générale du diagramme (P, T) d’un corps pur usuel est représentée ci-dessous :
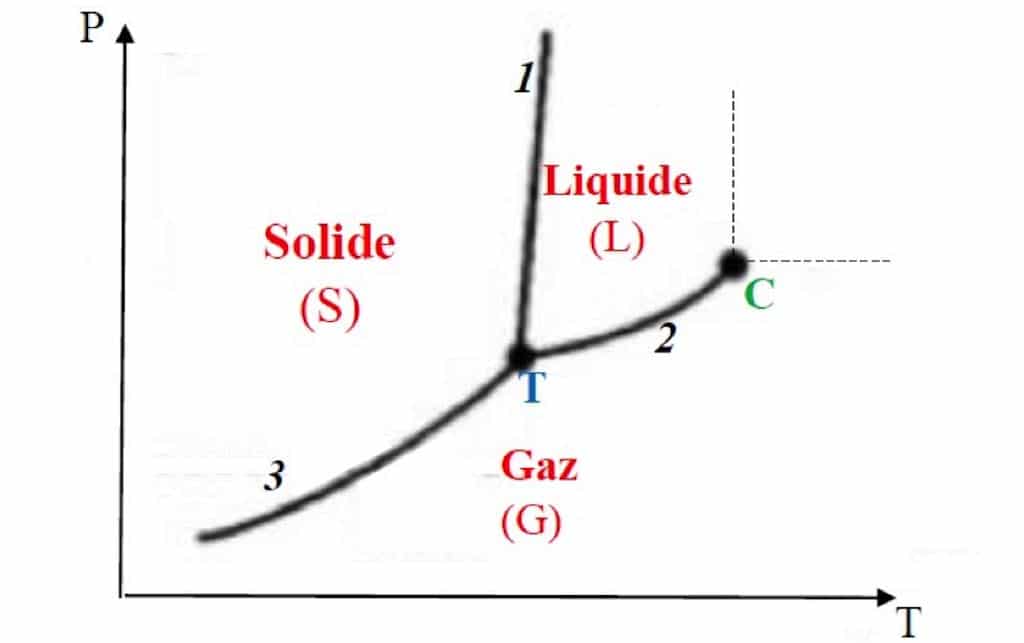
Allure générale du diagramme (P, T) d’un corps pur usuel
L’axe des abscisses correspond à la température (T) et l’axe des ordonnées correspond à la pression (P).
Nous pouvons remarquer que ce diagramme comporte :
- Trois régions (S, L et G). Chaque région correspond au domaine de stabilité de l’une des phases (solide, liquide ou gazeuse). Ainsi, pour tout couple (P, T) définissant un point situé dans l’un de ces domaines, le corps pur n’existe que sous une seule phase (la phase qui est stable dans ce domaine).
- Trois courbes (1, 2 et 3) qui séparent ces différentes régions et indiquent les conditions de température et de pression (i.e. l’ensemble des couples (P, T)) pour lesquelles (lesquels) deux phases peuvent coexister en équilibre.
La courbe de coexistence solide-liquide est appelée courbe de fusion (1), la courbe de coexistence liquide-gaz est appelée courbe de vaporisation (2) et la courbe de coexistence solide-gaz est appelée courbe de sublimation (3). - Un point T appelé « point triple » qui se trouve à l’intersection des trois courbes. En ce point unique, les trois phases (solide, liquide, gaz) coexistent en équilibre.
- Un point C appelé « point critique ». Au-delà de ce point, la distinction entre le liquide et le gaz n’est plus possible : une seule phase existe dont les propriétés sont intermédiaires entre celles d’un gaz et d’un liquide. Il s’agit du fluide supercritique.
Il est important de noter que, pour la plupart des corps purs, la pente de la courbe de fusion (1) est positive : la fusion provoque une dilatation.
Cependant, il existe quelques cas particuliers (ex : l’eau et le bismuth) pour lesquels la fusion provoque une contraction : la pente de la courbe de fusion est alors négative.
Il est également important de retenir que la pression de vapeur saturante d’un corps pur est la pression à laquelle le liquide et la vapeur coexistent à une température donnée. La courbe qui donne l’évolution de la pression de vapeur saturante en fonction de la température est donc la courbe de vaporisation du diagramme d’état.
En conclusion, les diagrammes d’état des corps purs usuels sont relativement simples à interpréter. Pour cela, il suffit de connaître les différentes notions abordées dans cet article.
Quelques informations complémentaires :
- Les corps purs à l’état solide se présentent souvent sous plusieurs phases appelées variétés allotropiques (ex : le graphite et le diamant sont deux variétés allotropiques du carbone). Les diagrammes de phases peuvent alors devenir plus complexes.
- Le diagramme de phases de l’hélium possède des particularités uniques (l’hélium présente deux phases liquides).

