Dans cet article, nous allons nous intéresser à la constante de vitesse k et plus particulièrement à son unité.
Tout d’abord, quelques rappels sont nécessaires. En effet, il faut savoir qu’à température fixée, une réaction admet un ordre si la loi de vitesse déterminée expérimentalement est de la forme :
v est la vitesse de la réaction,
k est la constante de vitesse de la réaction,
[A] est la concentration du réactif A,
[B] est la concentration du réactif B,
p est l’ordre partiel par rapport au réactif A
q est l’ordre partiel par rapport au réactif B.
L’ordre global de la réaction est égal à la somme des ordres partiels (cf. Article : La cinétique chimique formelle).
La constante de vitesse k dépend de la réaction étudiée et de la température. Son unité dépend de l’ordre global (n) de la réaction et elle peut être déterminée par une analyse dimensionnelle.
Exemple : Considérons la réaction de décomposition du chlorure de sulfuryle (SO2Cl2(g)) en dioxyde de soufre gazeux et dichlore gazeux.
L’équation de cette réaction est :
La vitesse volumique d’une réaction s’exprime usuellement en mol.L-1.s-1 et les concentrations molaires en mol.L-1.
L’unité de la constante de vitesse k peut être déterminée par une analyse dimensionnelle (la dimension d’une grandeur se note entre crochets).
Pour une réaction d’ordre global n = 1 :
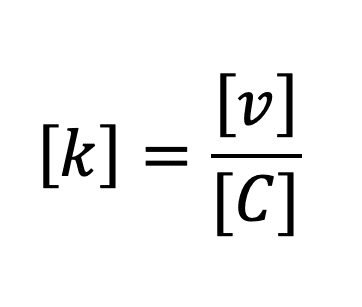
Ainsi, [k] = T-1 (T : symbole dimensionnel d’un temps).
Nous pouvons en déduire que, pour une réaction d’ordre global n = 1, l’unité usuelle de k est : s-1.
Dans chaque cas, l’unité de la constante de vitesse peut être retrouvée par une analyse dimensionnelle.
Astuce :
De façon générale, vous pouvez retenir que, pour une réaction d’ordre global n, la constante de vitesse k s’exprime usuellement en :
- Pour une réaction d’ordre global 0 (n = 0), k s’exprime usuellement en : mol.L-1.s-1
- Pour une réaction d’ordre global 1 (n = 1), k s’exprime usuellement en : s-1
- Pour une réaction d’ordre global 2 (n = 2), k s’exprime usuellement en : mol-1.L.s-1
- Pour une réaction d’ordre global 3 (n = 3), k s’exprime usuellement en : mol-2.L2.s-1
Remarque : dans certains exercices, l’unité de la constante de vitesse k peut permettre de retrouver l’ordre de la réaction par une analyse dimensionnelle.

