La méthode intégrale permet de vérifier l’ordre supposé d’une réaction. Elle repose sur l’utilisation des lois de vitesse sous leurs formes intégrées. Le principe de cette méthode est de faire une hypothèse sur la valeur de l’ordre d’une réaction, puis de confronter l’expression théorique obtenue avec les données expérimentales.
Dans cet article, nous considérons la réaction d’équation:
La vitesse volumique de cette réaction peut aussi s’exprimer comme suit :
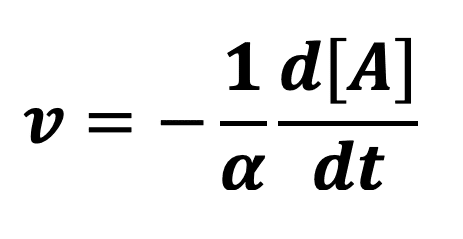
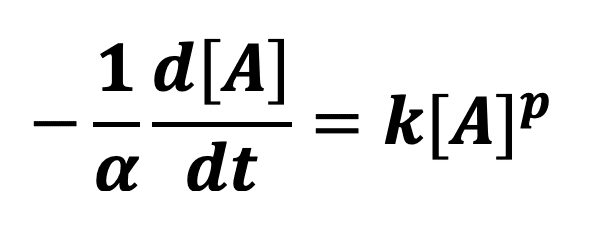
Hypothèse 1 : la réaction est d’ordre 0
En supposant que l’ordre partiel par rapport au réactif A est de 0 (p = 0), on peut écrire que :
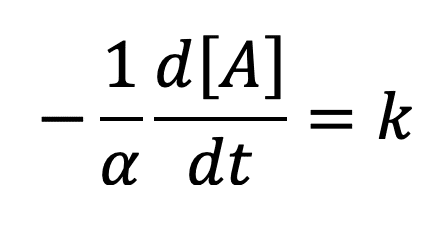
L’intégration de l’équation différentielle donne : [A]=[A]0– αkt
([A]0 : concentration initiale du réactif A)
Pour vérifier l’hypothèse 1, il faut tracer : [A] = f(t).
Si la réaction est d’ordre 0, on doit obtenir une droite de pente – αk et d’ordonnée à l’origine [A]0.
Si l’on n’obtient pas une droite, l’hypothèse est fausse : la réaction n’est pas d’ordre 0.
Remarque : les réactions d’ordre 0 sont rares.
Hypothèse 2 : la réaction est d’ordre 1
En supposant que l’ordre partiel par rapport au réactif A est de 1 (p = 1), on peut écrire que :
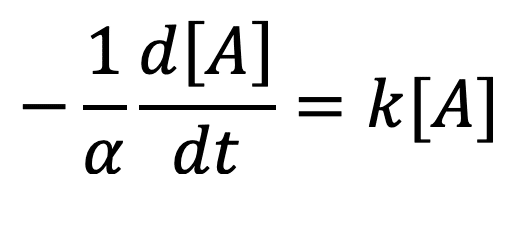
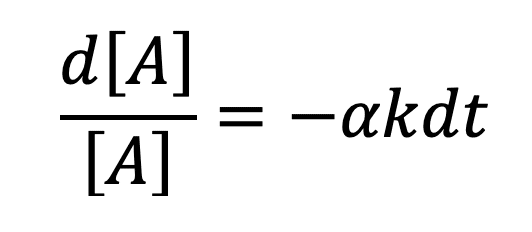
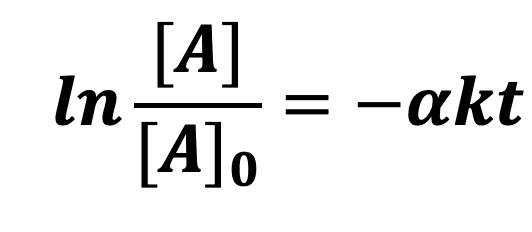
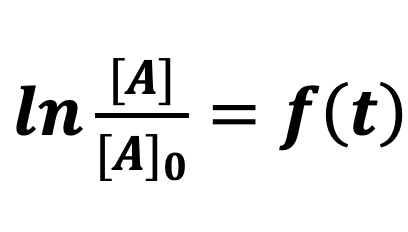
Si l’on n’obtient pas une droite, l’hypothèse est fausse : la réaction n’est pas d’ordre 1.
Hypothèse 3 : la réaction est d’ordre 2
En supposant que l’ordre partiel par rapport au réactif A est de 2 (p = 2), on peut écrire que :
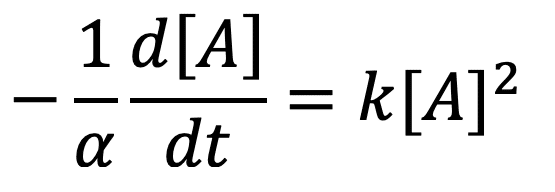
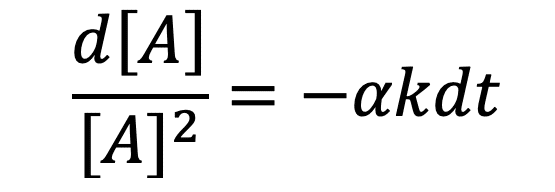
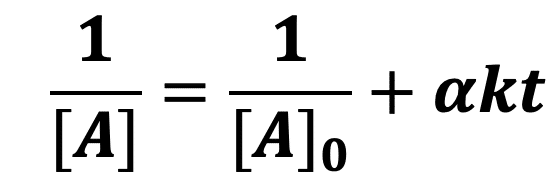
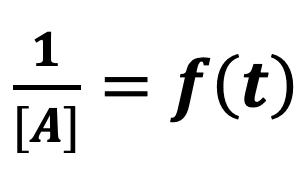
Dans cet article, nous avons considéré la loi de vitesse v = k[A]p avec p = 0, 1 ou 2.
En général, les lois de vitesse sont plus complexes, mais il faut savoir qu’il est possible de se ramener à une loi de cette forme en choisissant judicieusement les conditions expérimentales (méthode de la dégénérescence de l’ordre ou méthode du mélange stœchiométrique).

