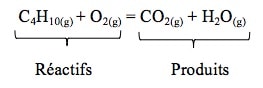Dans cet article, nous allons mettre en application la méthode proposée dans l’article « Savoir écrire et équilibrer une équation de réaction ».
Enoncé
Ecrire et équilibrer l’équation de la réaction de combustion complète du butane (gazeux) par le dioxygène.
Correction
1. Déterminer les réactifs et les produits, puis trouver les formules chimiques correspondantes :
Réactifs : butane (C4H10) et dioxygène (O2).
Produits : dioxyde de carbone (CO2) et eau (H2O).
2. Ecrire les formules chimiques des réactifs (séparées par un signe « + ») à gauche du signe égal (=) et les formules chimiques des produits (séparées par un signe « + ») à droite du signe égal (=) (en précisant les états physiques) :
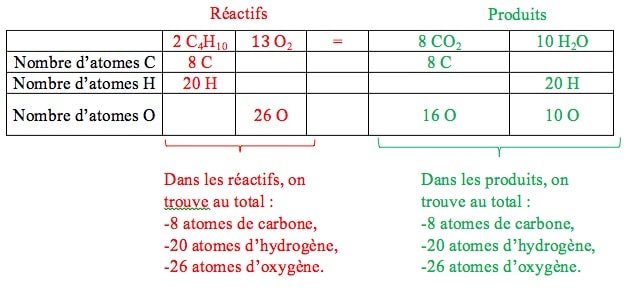
3. Comparer les éléments chimiques (en nature et en nombre) présents dans les réactifs et dans les produits :
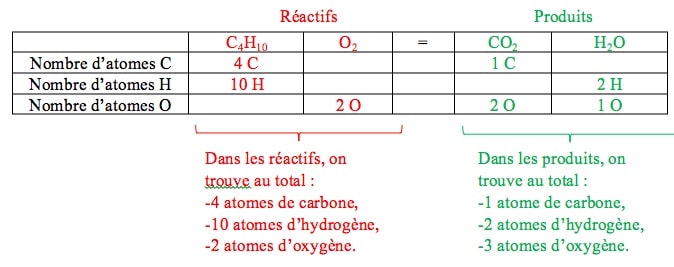
-Nature des éléments chimiques présents dans les réactifs et les produits : Dans les réactifs, nous trouvons les éléments carbone (C), hydrogène (H) et oxygène (O). Dans les produits, nous trouvons également les éléments carbone (C), hydrogène (H) et oxygène (O). Ainsi, nous retrouvons les mêmes éléments chimiques dans les réactifs et les produits.
-Nombre total d’atomes de chaque élément chimique dans les réactifs et les produits :
Il faut ajuster les coefficients stœchiométriques afin que le nombre total de chaque type d’atome soit identique dans les réactifs et les produits.
4. Ajuster les coefficients stœchiométriques afin de respecter la règle de conservation des éléments :
Il faut travailler élément par élément (si un corps simple est présent dans l’équation de réaction, il est conseillé d’ajuster en dernier le coefficient stœchiométrique de cette espèce).
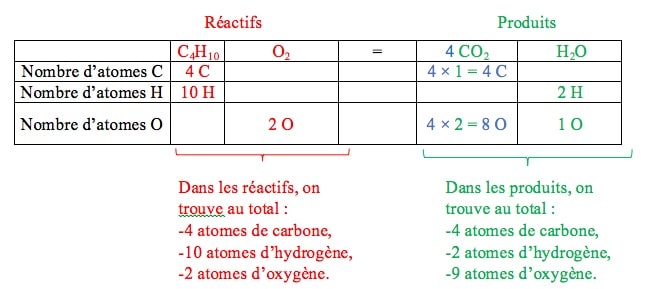
Nous commençons par le carbone (C) : il y a, au total, 4 atomes de carbone dans les réactifs et 1 atome de carbone dans les produits. Il faut donc multiplier par 4 le nombre d’atomes de carbone dans les produits.
Nous passons ensuite à l’hydrogène (H) : il y a désormais, au total, 10 atomes d’hydrogène dans les réactifs et 2 atomes d’hydrogène dans les produits. Il faut donc multiplier par 5 le nombre d’atomes d’hydrogène dans les produits.
Nous terminons par l’oxygène (O), car le corps simple O2 est présent dans l’équation de réaction.
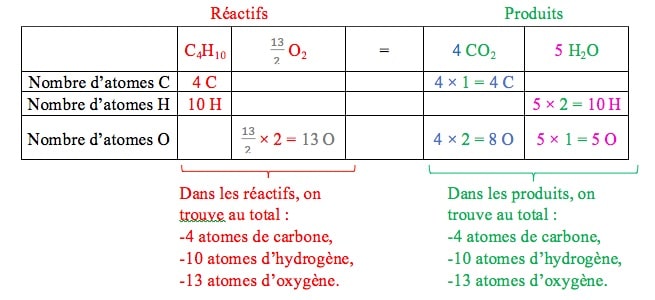
Nous constatons qu’il y a, au total, 2 atomes d’oxygène dans les réactifs et 13 atomes d’oxygène dans les produits. Il faut donc multiplier par 13⁄2 le nombre d’atomes d’oxygène dans les réactifs.
Pour avoir essentiellement des nombres stœchiométriques entiers, nous multiplions tous les coefficients par 2 :
Le nombre total de chaque type d’atome est donc identique dans les réactifs et dans les produits.
Ainsi, l’équation de la réaction de combustion du butane par le dioxygène peut s’écrire :
2 C4H10 + 13 O2(g) = 8 CO2(g) + 10 H2O(g)